IB 化学,属于 IB DP(Diploma Programme)课程体系的第四个学科组——科 学,IB 要求在科学组的六门学科中至少选择一门学习,化学是中国同学经常选 择的一个科目,可以选难度低的 SL(standard level)和难度高的 HL(higher level),18 年的全球考生数据显示,参加 5 月考试的 163,173 位考生中,15,
398 人选择了 SL,16,383 人选择了 HL,共占总人数的 19.5%,平均 5 个人 中会有 1 个人选化学。下面我们详细看一下具体的学习内容和评估方式。
一、SL 和 HL 的内容区别
难度低的 SL 必修有 11 章的核心内容(Core):定量分析关系、原子结构、化学 键与结构、周期性、热力学、动力学、化学平衡、酸碱反应、氧化还原反应、有 机化学和实验测量与数据处理,这 11 章的核心内容,SL 和 HL 的推荐教学时长 都是 95 小时。
难度高的 HL 多考察以下的 10 章的附加高级内容(Additional higher level): 电子的能量变化,过渡金属的特点和各类络合物,形式电荷和复杂分子形状,能 量循环、熵和反应自发性,化学速率方程和活化能,平衡常数与自由能关系,酸碱计算,原电池和电解池电势计算,各类有机反应和合成路径,各类谱图深入理 解,这些附加内容的推荐教学时长是 60 小时。
除了必修内容,还有四部分选修内容(Option):材料化学、生物化学、能源、 药物化学,SL 中推荐教学时长是 15 小时,HL 中推荐教学时长是 25 小时。
推荐教学时长加和后,HL 比 SL 要多学习 70 小时,总量加大的同时,知识点的 难度加深,,这些都是同学们选择时要做好的准备。
二、评估方式
化学和其他科目相同,单科最高 7 分,分为外部评价 EA(External Assessment) 和内部评价 IA(Internal Assessment)。
1. 外部评价 EA 占总成绩 80%,包括三张试卷:
SL
试卷 1:分值占比 20%,45 分钟,30 道选择题,每题 1 分,答错不倒扣分,考 察核心内容,其中 15 道题和 HL 相同,不可以使用计算器,提供元素周期表,
不提供数据公式手册。
试卷 2:分值占比 40%,1 小时 15 分钟,有填空题、简答题和计算题,总分 50
分,考察核心内容,可以使用计算器,提供数据公式手册。
试卷 3:分值占比 20%,1 小时,分为 A、B 两部分,A 部分有数据处理题目和 实验题,B 部分是 4 组选修部分的题目,挑选一组完成即可,总分 35 分。可以 使用计算器,提供数据公式手册。
HL
试卷 1:分值占比 20%,1 小时,40 道选择题,每题 1 分,答错不倒扣分,考 察核心内容和附加高级内容,其中 15 道题和 HL 相同,不可以使用计算器,提 供元素周期表,不提供数据公式手册。
试卷 2:分值占比 36%,2 小时 15 分钟,有填空题、简答题和计算题,总分 95
分,考察核心内容和附加高级内容,可以使用计算器,提供数据公式手册。
试卷 3:分值占比 24%,1 小时 15 分钟,分为 A、B 两部分,A 部分有数据处
理题目和实验题,B 部分是 4 组选修部分的题目,挑选一组完成即可,总分 45分。可以使用计算器,提供数据公式手册。
2. 内部评价 IA 占总成绩 20%,需要学生进行 10 小时的科学研究,完成 6 到
12 页的论文,研究过程会涉及亲自动手进行实验、用数据表格进行分析、从数 据库中提取数据进行画图分析、将实验结果和数据库相结合等。
总分 24 分,由学校老师评分,IB 官方审核,分别从以下 5 点评价:
(1). 个人投入,2 分,占比 8%,要展现出个人的兴趣、独立思考能力、研究要 有创造性和主动性。
(2). 探索研究,6 分,占比 25%,研究中要有清晰明确的问题,能够熟练运用 IB
dp 中学到的概念和技能。
(3). 数据分析,6 分,占比 25%,研究报告中要有对数据的选择、记录、处理和 解释,得出最终的结论。
(4). 研究评估,6 分,占比 25%,研究报告中要描述并评价自己的结论,评估研究的优点和缺点,给出改进建议和研究的拓展方向。
(5). 信息表达,4 分,占比 17%,清晰地展示自己的研究重点、研究过程和研究 结果。比如正确的图表命名,单位使用,小数点位数,参考文献的引用。
2018 年 5 月的成绩统计如下: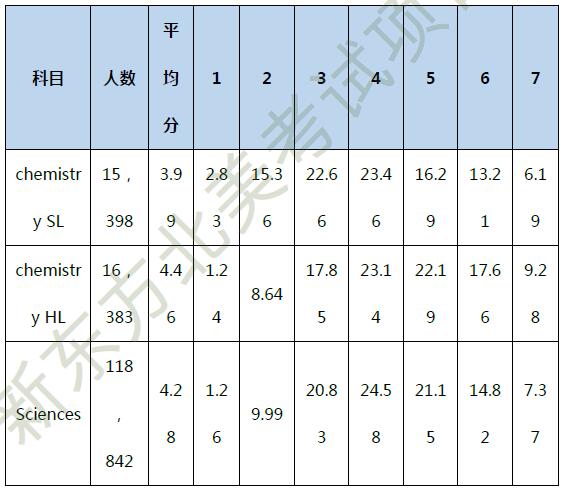
通过成绩可以看出,选择 HL 同学的平均分高于 SL 和科学类的平均分,而且更多人集中在高分段,满分率虽然不到 10%,也在 19 门科学考试中排第六,说明选择 HL 的同学已经通过之前的学习,具备了较好的化学素养。
三、知识点详解
Ⅰ核心内容(Core)
1. 定量分析关系
1.1 物质的粒子属性和化学变化:化合物由不同类的原子组成,混合物由多种单 质或化合物组成,混合物的同质性和异质性。
1.2 摩尔概念:摩尔是粒子的固定数量,原子质量的衡量,经验式和分子式的区 别。
1.3 反应的质量和体积:反应物的不足和过量判断,实验值和理论值的差别,阿 伏伽德罗定律,理想气体的摩尔体积,摩尔体积浓度,标准溶液。
2. 原子结构
2.1 原子内部结构:原子包含带正电的原子核,原子核由质子和中子组成,带负 电的电子分布在核外,质谱仪可以分辨不同质量的同位素。
2.2 电子构型:电子从高能量状态回到低能量状态能产生发射光谱,氢离子的线 状发射光谱提供电子能级存在的证据,主能级决定其中电子的最大数量,主能级 可以被细分为 s、p、d、f 的次能级,次能级包含固定数量的轨道,轨道由对应 的能量状态,每个轨道可以盛放自旋方向相反的两个电子。
3. 周期性
3.1 元素周期表:元素周期表对应次能级的分区,元素在一行和一列内的周期变 化,周期数和主能级数的对应,用主能级数和价层电子数推导原子的位置,金属、 非金属、半金属在周期表上的位置。
3.2 周期性:原子半径、离子半径、电离能、亲合能、电负性、金属性、非金属 性随周期表的横向和纵向变化,氧化物从碱性到两性最后到酸性的变化。
4. 化学键与结构
4.1 离子键:金属失去电子变为阳离子,非金属获得电子变为阴离子,通过电子 排布判断得失电子,异种电荷的相互静电吸引形成离子键,离子化合物通常是具 有晶格结构的固体。
4.2 共价键:共用电子对和原子核之间的静电吸引力形成共价键,单键、双键、 叁键的结构、键长和键能,成键原子的电负性差值决定键的极性。
4.3 共价键结构:路易斯结构式的画法,八隅体规则的使用及例外情况,共振结 构的发生情况,用 VSEPR 理论解释分子的形状,碳和硅可以形成巨型网状共价 键结构。
4.4 分子间作用力:伦敦色散力、取向力、氢键的理解与相对强弱的比较。
4.5 金属键:离域电子和晶格分布的阳离子之间的吸引力形成金属键,金属键的 强度取决阳离子电荷和半径,合金通常包含多种金属,部分性质被提高。
5. 热力学
5.1 测量能量变化:热是能量的一种形式,温度可以衡量粒子平均动能,化学反 应中能量守恒,通过环境和体系的热量交换判断反应是吸热还是放热,焓变和标 准焓变的理解。
5.2 汉斯定律:反应焓变可以通过分步反应焓变求和得到。
5.3 键能:形成键释放能量,破坏键吸收能量,平均键焓是破坏 1 摩尔气态分子 键的能量。
6. 动力学 碰撞理论和反应速率:足够能量且合适方向的碰撞会产生化学反应,反应速率用 特定物质单位时间的浓度变化来衡量,浓度变化可以通过质量、体积、颜色的变 化间接测量,分子碰撞发生化学反应需要的最小能量是活化能,催化剂可以通过 减少活化能加速化学反应,自身不发生化学性质变化。
7. 化学平衡 封闭系统中正逆反应速率相等时达到平衡状态;平衡方程可以计算平衡常数,平 衡常数表示反应进行的程度,只受温度影响;反应商表示反应物和生成物的相对 数量;浓度、压强和温度改变时平衡会发生改变;催化剂对平衡位置和平衡常数 没有影响。
8. 酸碱反应
8.1 酸碱理论:Br?nsted-Lowry 理论中酸给出质子,碱接受质子,两性物质既 可以是酸也可以是碱,共轭酸碱对相差一个质子。
8.2 酸碱的性质:酸与活泼金属、金属氧化物、金属氢氧化物、碳酸盐、碳酸氢 盐的反应,酸碱反应生成盐和水。
8.3 pH 值:pH 值的计算,对应的溶液酸碱性,水的离子积常数。
8.4 酸碱的强弱:酸碱强弱的区别是电离程度,相同浓度的强酸强碱的导电性大 于弱酸弱碱,越强的酸碱对应的共轭酸碱越弱。
8.5 酸沉降:因为溶解了二氧化碳,正常的雨呈酸性;溶解了氮、硫氧化物的酸 雨 pH 更低,氮;硫氧化物的源头和酸雨的危害。
9. 氧化还原反应
9.1 氧化反应与还原反应:氧化还原反应可以从得氧失氢、电子转移和氧化数变 化等方面理解;氧化剂被还原,还原剂被氧化;过渡金属和多数非金属都有多个 氧化数;金属活动性顺序表;Winkler 方法可以用来测量生化需氧量,反映水污 染的程度。
9.2 电化学电池:伏打电池把自发放热化学反应的能量转换为电能,阳极发生氧
化反应,是负极,阴极发生还原反应,是正极;电解池把电能转换为非自发反应 的化学能,阳极发生氧化反应,是正极,阴极发生还原反应,是负极。
10. 有机化学
10.1 有机化学基础:同系物有相同的通式,相差相同的结构单元;结构式和结 构简式两种形式;同分异构体的分子式相同但原子排列不同;官能团决定分子的 性质;饱和化合物只有单键,不饱和化合物有双键或叁键;苯是芳香族不饱和碳 氢化合物。
10.2 官能团基础知识点:烷烃反应活性低,可以发生自由基取代反应;烯烃比 烷烃活泼,可以发生加成反应,溴水可以用来区分烷烃和烯烃;醇可以与酸发生 亲核取代,有些可以发生氧化反应;卤代烃比烷烃活泼,可以发生亲核取代,亲 核试剂有孤对电子,可以提供给缺电子的碳;加成聚合物的单体范围很广,是塑 料工业的基础;苯不容易发生加成反应,可以发生亲电子取代反应。
11. 实验测量与数据处理
11.1 实验测量和结果的不确定度和误差:定性数据包含观测中得到的非数据类 信息;定量数据由测量得到,会有误差和不确定度,产生原因可能是实验仪器和
108
北京新东方学校北美考试项目部
实验人员;误差传播显示了不确定度对最终结果的影响;实验设计和实验过程会 导致系统误差,使实验结果偏向特定方向;重复实验和测量可以减少随机误差但 不能减少系统误差。
11.2 图象分析方法:图象分析方法可以有效显示自变量对因变量的影响;没有 特定刻度的草图可以显示定性趋势,比如正比或反比关系;定量测量中坐标轴有 准确的刻度和名称。
11.3 有机化合物的光谱鉴别:不饱和度可以用来确定分子式中碳环、不饱和键 的数量;质谱、核磁共振和红外光谱可以用来识别化合物的结构
Ⅱ附加高级内容(Additional higher level)
12. 原子中的电子:发射光谱中,高频率的汇聚极限对应第一电离能,第一电离 能的周期性变化解释了主能级和次能级的存在,一个元素的连续电离能可以显 示电子排布的情况。
13. 过渡金属
13.1 第一行过渡金属:过渡金属有多种氧化数,可以和配体形成络合物,可以
形成有颜色的化合物,有催化性和磁性;锌的离子没有不完整的 d 轨道,不被 当作过渡金属;当 s 亚层电子被移走,过渡金属的氧化数为 2。
13.2 有色络合物:d 亚层的轨道分为能量不同的两组;因为 d 轨道的电子吸光 能变成激发态,d 区的络合物有颜色。
14. 化学键与结构
14.1 共价键的深入理解:σ键和π键的形成方式,形式电荷的计算,八隅体规则 的例外情况,离域共价键的特点,共振结构的表示。
14.2 杂化:杂化轨道是由不同类型轨道混合后形成的。
15. 热力学
15.1 能量循环:涉及水合作用、原子化、亲合能、晶格能、共价键和溶液形成 过程的能量变化。
15.2 熵和反应自发性:熵的定义,吉布斯自由能的定义,与焓、熵、绝对温度 之间的关系。
110
16. 动力学
北京新东方学校北美考试项目部
16.1 速率方程和反应机理:多步反应中最慢的反应决定总反应的速度;反应级
数可以是整数或分数,对应决速步反应的粒子数;速率方程只能由实验数据得到; 速率常数受温度影响,单位由总反应级数决定;催化剂通过引入活化能低的反应, 改变反应机理。
16.2 活化能:阿仑尼乌兹方程用温度和速率常数判断活化能,频率因数与合适 方向的碰撞频率有关。
17. 化学平衡方程:用平衡常数解释勒夏特列定律对浓度变化的描述;平衡常数 和吉布斯自由能之间的关系。
18. 酸碱
18.1 路易斯酸碱:路易斯酸接受孤对电子,路易斯键给出孤对电子;路易斯酸 碱反应生成配位化合物;亲核试剂是路易斯碱,亲电子试剂是路易斯酸。
18.2 酸碱计算:弱酸弱碱解离常数的理解;共轭酸碱解离常数的关系。
111
北京新东方学校北美考试项目部
18.3 pH 曲线:pH 曲线反应中和反应的过程 pH 变化,pH 曲线上的缓冲区域 能够抵抗一定的酸碱影响;酸碱指示剂是弱酸或弱碱,对用的共轭酸碱颜色不同。
19. 电化学电池:伏打电池电动势的计算,标准氢电极的组成,电解水溶液,电 势与吉布斯自由能的关系,电镀过程的理解。
20. 有机化学
20.1 有机化学反应:亲电子取代反应,亲电子加成反应,亲核取代反应,还原 反应。
20.2 有机合成路线:通过多步的官能团转换来制备目标化合物。
20.3 立体异构线性:构象异构体可以通过旋转单键转换,构型异构体只能通过 断键和成键转换;顺反异构在烯烃和环烷烃中发生;手性碳的特点。
21. 光谱鉴别有机化合物:用红外谱图、核磁共振谱图、质谱图来分辨化合物的 机构特征,X 射线晶体学可以用来识别晶体化合物的键长和键角。
Ⅲ选修内容(Option)
北京新东方学校北美考试项目部
A. 材料学:材料化学基础,耦合等离子体(ICP)光谱学,各类催化剂,液晶,高
分子,纳米技术,塑料的环境影响。
B. 生物化学:生物化学基础,蛋白质、酶、脂肪、碳水化合物、维生素,生化 与环境。
C. 能源:化石燃料,核裂变与核聚变,太阳能,全球气候变暖等环境问题。
D. 药物化学:医药产品和药物作用,阿司匹林和青霉素,麻醉剂,胃中 pH 的 调节,抗病毒药物,药物对环境的影响。
四、例题分析
Calcium carbide, CaC2, is an ionic solid. (1) Describe the nature of ionic bonding.
(2) Describe how the relative atomic mass of a sample of calcium could
be determined from its mass spectrum.
(3) When calcium compounds are introduced into a gas flame a red color is seen; sodium compounds give a yellow flame. Outline the source of the colors and why they are different.
(4) (i) Suggest two reasons why solid calcium has a greater density than solid potassium. (ii) Outline why solid calcium is a good conductor of electricity.
(5) Sketch a graph of the first six ionization energies of calcium.
(6) Calcium carbide reacts with water to form ethyne and calcium hydroxide.
CaC2(s) + H2O(l) → C2H2(g) + Ca(OH)2(aq)
Estimate the pH of the resultant solution
(7) (i) Describe how sigma (s) and pi (p) bonds are formed. (ii) Deduce
the number of s and p bonds in a molecule of ethyne.
本题从多个角度考察了多个章节的内容,各问题的考察点和章节如下:
(1)离子键的定义与特点,考察第四章化学键与结构。
(2)质谱仪分离同位素的原理,考察第二章原子结构。
(3)不同颜色的可见光对应不同能量的电子跃迁,考察第二章原子结构。
(4)金属键的强弱和金属导电性的理解,考察第四章化学键与结构。
(5)跨层的电离能变化,考察第三章周期性。
(6)酸碱的识别,考察第八章酸碱反应。
(7)共价键的理解,考察第四章化学键与结构。
五、与 AP/A-level 化学对比
经常和 IB 课程一起谈论的是 AP 和 A-level 两种国际课程,这其中 IB 和 A-level 要求学生必须在校学习对应的化学课程,取得成绩,才能获得官方认证,而 AP 化学并不需要学生在校进行课程学习,可以只参加最终考试,获得 5 分的成绩, 证明自己的化学水平来换取学分。时间上,AP 化学通常是一年的学习内容,而
IB 和完整的 A-level 都需要两年才能完成。因此,考试内容上 AP 化学的考察范
围和各部分的深度也低于 IB 的 HL 和 A-level,最明显的是有机化学部分知识 点,AP 没有过多要求,而 IB 和 A-level 都重点讲解,IB 中的有机化学是必修核 心板块中的第 10 章,而在 A-level 中化学被直接分成了物理化学、无机化学、 有机化学三大板块,分别详细讲解。IB 化学的选修部分在 AP 和 A-level 都没有 过多强调。
六、总结
通过以上的系统介绍,相信大家对 IB 化学有了充分准确的认识,IB 化学需要同 学掌握课程要求的必备知识点,并能够把知识点充分消化吸收,应用于实际的实 验研究中,具备创新思维和能力,能够发现问题,独立思考,通过合作交流,实 验探究,解决问题,学习时务必要高度重视,从一开始就调整好自己的学习节奏, 保证学习质量,这样才能满足 IB 课程的要求,同时培养自己的科学素养,提高自己的科研能力,为将来的学习和职业发展打下坚实的基础。
(责任编辑:admin)
时间管理 行为重塑和托福80分说再见
①凡本网注明“稿件来源:新东方国际教育北京学校”的所有文字、图片和音视频稿件,版权均属新东方国际教育北京学校所有,转载请注明“来源:新东方国际教育北京学校”。
② 本网未注明“稿件来源:新东方国际教育北京学校”的文/图等稿件均为转载稿,本网转载仅基于传递更多信息之目的,并不意味着赞同转载稿的观点或证实其内容的真实性。如其他媒体、网站或个人从本网下载使用,需自负版权等法律责任。如擅自篡改为“稿件来源:新东方国际教育北京学校”,本网将依法追究法律责任。
③如有本网转载稿涉及版权等问题,请作者见稿后速来电与新东方国际教育北京学校联系,电话:010-62578989。